酸化:物質が酸素と結合すること、水素を失うこと、電子を放出すること
還元:物質が酸素を失うこと、水素と結合すること、電子を受け取ること
酸化と還元
酸化と還元は表裏一体の反応です。
酸化が起こっていれば同時に還元も起こっています。
この反応をまとめて酸化還元反応と呼びます。
酸素のやり取り
酸化は読んで字の通り《酸素が結合すること》です。
逆に還元は《酸素を放出すること》を言います。

水素のやり取り
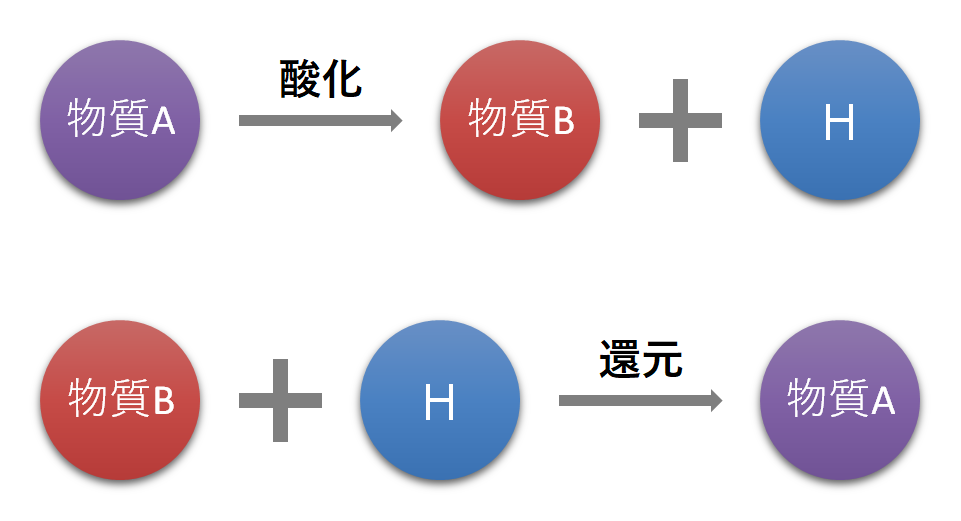
水素を中心に見た場合の酸化と還元の関係を解説します。
酸化は《水素を放出すること》です。
還元は《水素を受け取ること》です。
電子のやり取り
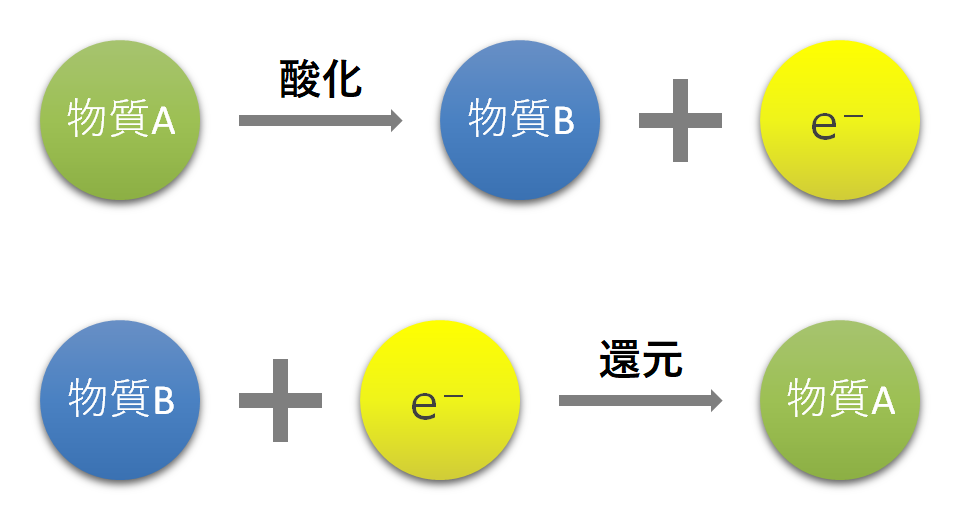
電子を中心に見た場合の酸化と還元の関係を解説します。
酸化は《電子を放出すること》です。
還元は《電子を受け取ること》です。
酸化数
酸化と還元について、酸素の授受はわかりやすいですが、水素・電子の授受はわかりにくいですね。
ここでは、酸化数という考え方を説明します。
まずは、原子や分子の周辺にある数字についておさらいしておきましょう。

酸化数とは《物質が持つ電子の数が基準より多いか少ないかを示す数字》になります。
酸化数が+であれば、その物質は電子(e-)が少ない状態(陽子(+)が多い状態)を表します。
つまり、酸化数は分子やイオンの電荷と一致します。
酸化数の求め方についてはルールを2種類覚えましょう
単体の酸化数は0
化合物全体の酸化数は0
イオン全体の酸化数は電荷に等しい
①アルカリ金属(K、Naなど)の酸化数は+1、アルカリ土類金属(Mg、Caなど)の酸化数は+2、ハロゲン(F、Cl、Br、Iなど)の酸化数は-1
②水素原子(H)の酸化数は+1
③酸素原子(O)の酸化数は-2
④硫黄元素(S)の酸化数は-2
過酸化水素の酸素原子の酸化数は-1
例題として以下の物質について酸化数を確認してみましょう。
例1)H2S

例2)Al3+

例3)CuO

では、酸化数をもとに酸化、還元を考えてみましょう。
例)酸化銅に活性炭を混ぜて加熱する

化学反応式の書き方も再度見直しておきましょう。
最後に酸化・還元をまとめると下のようになります。

酸化剤と還元剤
酸化還元反応で《相手を酸化する物質(自身は還元される物質)》を酸化剤
《相手を還元する(自身は酸化される物質)》を還元剤と呼びます。












