電離:物質が陽イオンと陰イオンに分離する現象
酸:水素イオン(H+)を放出する物質
塩基:水素イオンを受け取る物質(または水酸化イオン(OH-)を放出する物質)
中和:酸と塩基が反応して水と塩(エン)ができる反応
電離と電離度
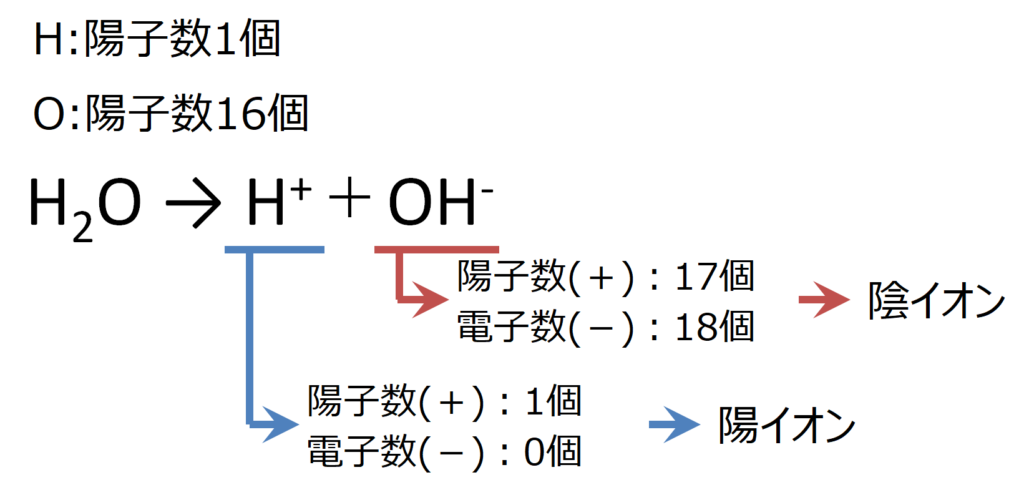
電離とは《物質を水に溶かした時に陽イオンと陰イオンに分かれること》を言います。
通常、物質は物質内で陽子と電子の数が一致しており、電荷として±0となっています。
この物質が水に溶ける際に2つに分離する場合があります。
分離したとき、一方に電子が多く(もう一方に陽子が多く)分離する物質を電解質と呼びます。
陽子より電子が多くなった物質はマイナスの電荷を持つ陰イオンとなります。
逆に陽子が電子より多くなった物質はプラスの電荷を持つ陽イオンとなります。
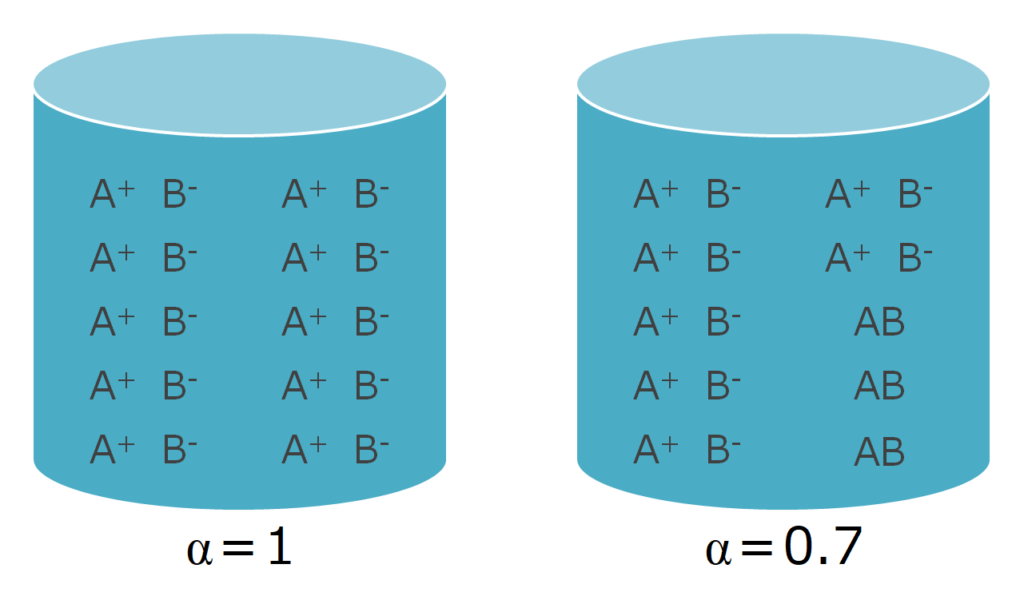
 また、電解質は種類によって水に溶かしたときに電離する度合い(イオンになる量とイオンにならないまま存在する量)が異なります。
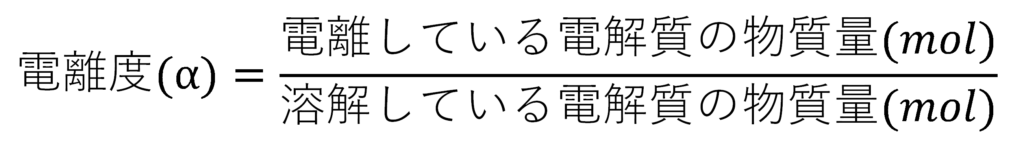
また、電解質は種類によって水に溶かしたときに電離する度合い(イオンになる量とイオンにならないまま存在する量)が異なります。
この電離する割合のことを電離度と呼びます。
酸と塩基
酸と塩基にはいくつかの定義がありますが、ここではBrønsted-Lowry(ブレーンステッド-ローリー)の定義にある酸と塩基を説明します。
酸とは《電離した時に水素イオン(H+)を放出する物質》のことです。
酸で有名な物質として塩化水素(水溶液は塩酸)があります。
塩化水素を水に溶かしたときの電離は下のようになります。
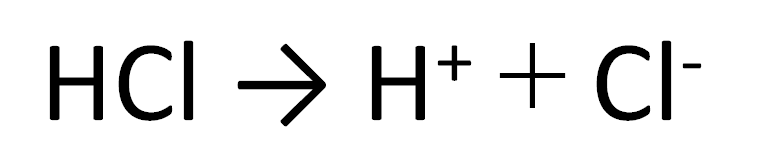
また塩基(アルカリ)とは《H+を受け取る(水酸化イオン(OH-)を放出する)物質》のことです。
塩基で有名な物質として水酸化ナトリウムがあります。
水酸化ナトリウムを水に溶かしたときの電離は下のようになります。

中和
中和とは《酸と塩基が反応して水と塩(エン)ができる反応》です。
例として、塩化水素(酸)と水酸化ナトリウム(塩基)を混ぜる中和反応を考えてみましょう。
塩化水素と水酸化ナトリウムの電離は上に示したとおりです。
ここで、それぞれ電離した陽イオンと陰イオンをくっつけると下のようになります。

つまり、結果としてできる塩はNaCl(塩化ナトリウム)となります。










