質量保存の法則:化学反応前後の質量の総和は等しい
定比例の法則:1つの化合物を構成する元素の質量比は常に一定
倍数比例の法則:2種類以上の元素(例えば元素AとB)がいくつかの異なる化合物を作るとき、一定質量の元素Aと元素Bの質量の間には簡単な整数比が成り立つ
アボガドロの法則:気体の種類に関係なく、同一温度、同一圧力下では同じ体積中に同じ数の分子を含む
質量保存の法則
質量保存の法則とは《化学反応前後の質量の総和は等しい》という法則です。
質量は原子量の総計になるということと、化学反応では原子は消失したり新たに生成されたりしない、ということを理解していれば理解は容易いかと思います。
では、いくつかの化学反応を参考に確認していきましょう。
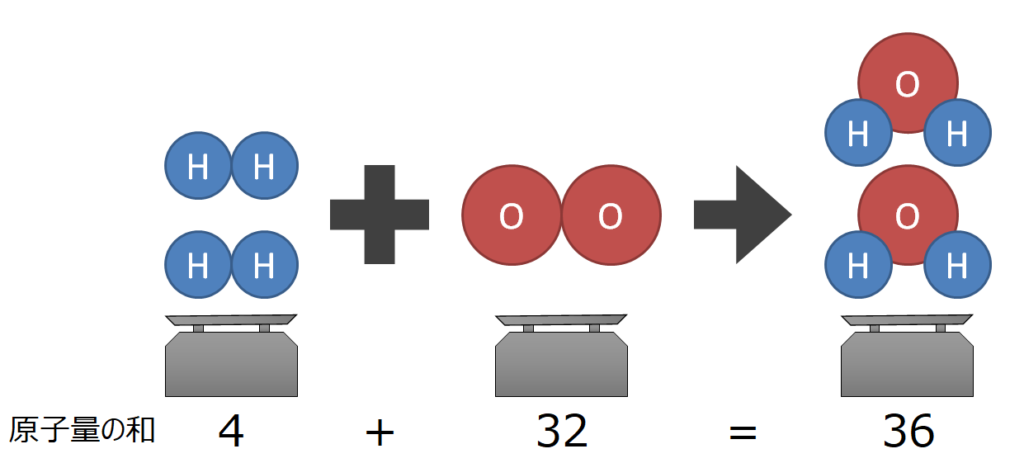
例1)水素と酸素が反応(燃焼)して水ができる
反応式:2H2+O2→2H2O
反応前の質量はH2(分子量:2)が2個、O2(原子量:32)が1個
(2×2)+(32×1)=36
反応後の質量はH2O(分子量:18)が2個
18×2=36
例2)炭酸水素ナトリウムを加熱すると炭酸ナトリウムと水と二酸化炭素になる
反応式:2NaHCO3→Na2CO3+H2O+CO2
反応前の質量はNaHCO3(分子量:84)が2個
84×2=168
反応後の質量はNa2CO3(分子量:106)が1個、H2O(分子量:18)が1個、CO2(分子量:44)が1個
(106×1)+(18×1)+(44×1)=168
定比例の法則
定比例の法則とは《1つの化合物を構成する元素の質量比は常に一定》という法則です。
若干分かりづらいですが、化学式で書いてみたらわかりやすいかと思います。
では化学式で確認していきましょう。
例)水
化学式;H2O
水分子(分子量:18)が1つある場合、水素原子は2つあるので質量は2、酸素原子は1つあるので質量が16となっています。
では水分子が2つある場合はどうでしょうか。
水分子が2つの場合、水素原子は4つあるので質量は4、酸素原子は2つあるので質量が32となります。
ここで、水分子を構成する原子の質量比を確認してみると・・・
1分子のとき 水素:酸素=2:16=1:8
2分子のとき 水素:酸素=4:32=1:8
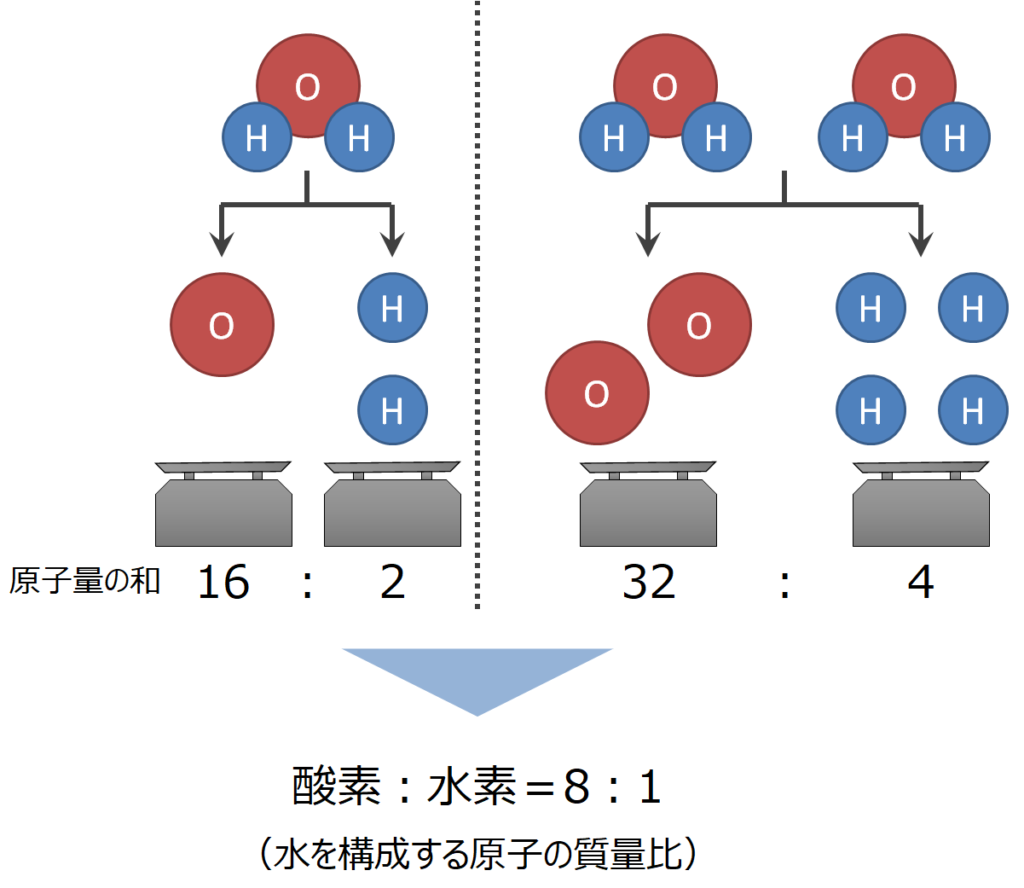
つまり、水を構成する元素の質量比は 水素:酸素=1:8 で常に一定となります。
グラフに表すと下のようになります。

倍数比例の法則
倍数比例の法則とは《2種類以上の元素(例えば元素AとB)がいくつかの異なる化合物を作るとき、一定質量の元素Aと元素Bの質量の間には簡単な整数比が成り立つ》という法則です。
これも若干わかりにくいですね・・・化学式で確認してみましょう。
例)炭素と酸素でできる化合物、一酸化炭素と二酸化炭素
化学式:CO(一酸化炭素)、CO2(二酸化炭素)
一酸化炭素は炭素:酸素=1:1
二酸化炭素は炭素:酸素=1:2
の比率で元素が結合しています。
つまり、炭素1元素あたりの酸素元素の数を比率にすると、以下のようになります。
一酸化炭素の酸素元素:二酸化炭素の酸素元素=1:2

アボガドロの法則
アボガドロの法則とは《気体の種類に関係なく、同一温度、同一圧力下では同じ体積中に同じ数の分子を含む》という法則です。
重要なのは標準状態(0℃、1atm)では、種類に依らず気体分子6.02×1023個が占める体積は22.4 Lという点です。また、6.02×1023個は桁が大きいので1molと表します。
また、1molの原子数の質量は原子量にgをつけた重さとなります。
つまり、酸素原子であれば原子1個では原子量16(単位なし)であり、原子1mol個では質量16 gとなります。









